
细胞入侵和迁移实时测量 (RTCA)DP实时细胞分析仪
xCELLigence®实时细胞分析(RTCA)DP仪器使用无创电阻抗监测,以无标签的实时方式量化细胞增殖,形态变化和附着质量。 DP模型与其他xCELLigence仪器的区别是其使用电子集成的Boyden室(CIM-Plate®16)进一步对细胞侵袭和迁移(CIM)进行动力学测量的能力。 DP仪器的三个支架允许三个独立的电子16孔板并联或彼此独立地进行控制和监控,从而实现多个用户的最大生产力。将仪器置于标准的CO2细胞培养箱中,并通过连接到孵化器外部的控制单元(笔记本电脑)的电缆进行供电和控制。用户友好的RTCA软件允许与所有三个支架实时接口,并包括实时数据显示和分析功能。
细胞阻抗说明
在细胞生物化学测定和全身生物体内实验之间定位,基于细胞的测定是基础和应用生物学研究不可缺少的工具。然而,许多基于细胞的测定法的用途通过以下方式减少了:(1)需要使用标记;(2)与连续监测不相容(即仅产生终点数据);(3)与正交试验不相容;和( 4)无法提供客观/定量的读数。然而,这些缺点都是通过非侵入性的,无标记的和实时的细胞阻抗测定来克服的。 细胞阻抗测定的功能单元是融合到微量滴定板孔的底部表面的一组金微电极(图1)。当浸没在导电溶液(如缓冲液或标准组织培养基)中时,在这些电极上施加电位会使电子离开负极,通过本体溶液,然后沉积到正极端以完成电路。因为这种现象取决于电极与本体溶液相互作用,所以在电极 - 溶液界面处的粘附细胞的存在阻碍了电子流动。该阻抗的大小取决于细胞的数量,细胞的大小和形状以及细胞 - 基底附着质量。重要的是,金微电极表面和施加的电位(22 mV)都不影响细胞的健康或行为。
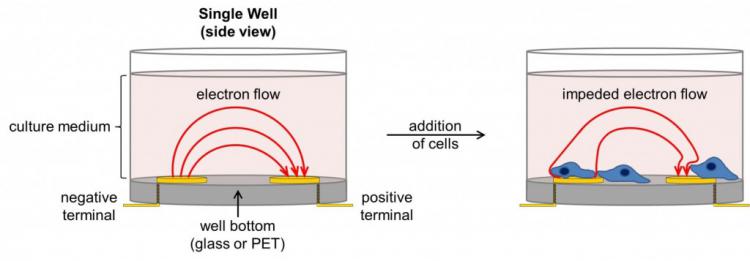 图1.
图1.细胞阻抗装置概述在单元格添加之前和之后显示单个孔的侧视图。电极和电池都不被拉伸(为了清晰起见,它们被放大)。在不存在电池的情况下,电流自由流动通过培养基,完成电极之间的电路。由于细胞在电极上粘附并增殖,电流流动受阻,提供了细胞数量,细胞大小/形态以及细胞 - 基质附着质量的非常灵敏的读数。
阻抗电极
ACEA E-Plate板中每孔中的金微电极生物传感器覆盖70-80%的表面积(取决于是否存在视野区域)。而不是图1所示的简化的电极对,E-Plate板的每个孔中的电极被连接成形成交错阵列的“线”(图2)。这种布置可以同时监测细胞群体,从而提供精确的灵敏度:附着于板的细胞数,细胞的大小/形态以及细胞 - 基质附着质量。
 图2.
图2. ACEA E-Plate板上的阻抗电极。 (A)E-Plate板的每个孔中使用的叉指电极的简化示意图。电极没有按比例绘制(仅显示一些电极,为了清晰起见,它们已被放大)。虽然细胞也可以在金电极表面上可视化,但在中间的无电极区域有助于显微成像(亮场,荧光等)。 (B)16孔E-Plate板中单孔的照片。 (C)放大阴影电极和未染色人体细胞的明场图像。 (D)复合显微镜中观察到的金电极和结晶紫染色的人细胞。
用于实时细胞迁移/浸润的设备
尽管它可以与其他xCELLigence仪器一样运行测试,但是xCELLigence RTCA DP模型具有使用ACEA CIM-Plate进行实时细胞侵袭/迁移测定的附加功能,该实验基本上是电子集成的Boyden室。如图3A所示,将细胞直接置于微孔膜的顶部(迁移测定)上或在预先沉积在膜上的基底膜基质和/或细胞单层的顶部(入侵测定)上放置在上室中。移动到下腔室的化学引诱剂,细胞通过微孔膜,然后沉积到金阻抗电极上(在本技术概述的前两节中描述)。这提供了细胞迁移/侵袭的非常灵敏和可重复的连续动力学记录(图3B)。使用显微成像定量迁移细胞的平行测定证明了CIM-Plate的阻抗信号与已经迁移的细胞数量之间的完美相关性。
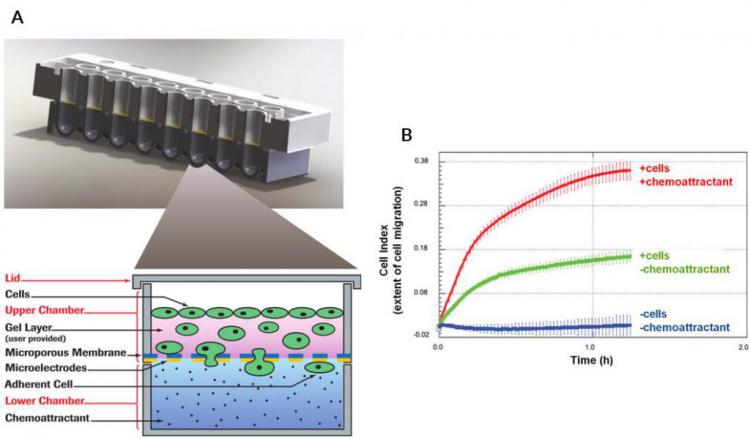 图3.
图3.细胞侵袭/迁移的定量实时分析。 (A)CIM板细节。上图显示了CIM-Plate八孔的剖视图。下图中的放大图示出了单个孔的上部和下部室。上室的底表面由细胞可以迁移穿过的微孔膜组成。该膜下侧的金电极检测粘附细胞的存在。对于简单的迁移测定(本文未示出),被监测的细胞将直接电镀在膜上。对于入侵测定(在此显示),将细胞铺在基底膜基质,细胞单层或其某些组合的顶部。 (B)在存在或不存在化学引诱物的情况下实时分析鼠巨噬细胞迁移。在没有细胞(阴性对照;蓝线)的情况下,阻抗信号在测定的75分钟内不变。虽然一些细胞在不存在化学引诱物(绿线)的情况下迁移通过多孔膜,但当化学引诱物存在于CIM板的下室(红线)时,巨噬细胞迁移显着刺激。
图“B”改编自PLoS One。 2013年3月8(3):e58744。
实时阻力跟踪说明
使用称为细胞指数(CI)的无单位参数报告了由贴壁细胞引起的电子流的阻抗,其中CI=(时间点n阻抗-不存在细胞时阻抗)/标称阻抗值。图3提供了在建立和运行凋亡实验过程中实时阻抗曲线的通用示例。在细胞添加到孔中的头几个小时之后,阻抗快速增加。这是由于悬浮液中的细胞脱落,沉积在电极上并形成局部粘连。如果添加的细胞的初始数量低,并且在井底上存在空的空间,则细胞将增殖,导致CI逐渐但稳定增加。当细胞达到汇合CI值时,反映了大容量介质可接近的电极表面积不再改变的事实。此时加入细胞凋亡诱导剂导致CI降低至零。这是细胞四舍五入,然后从井底分离的结果。虽然这个通用实例涉及细胞融合时的药物添加,基于阻抗的测定是非常灵活的,并且还可以评估初始细胞粘附到电极的速率和程度,或细胞增殖的速率和程度。
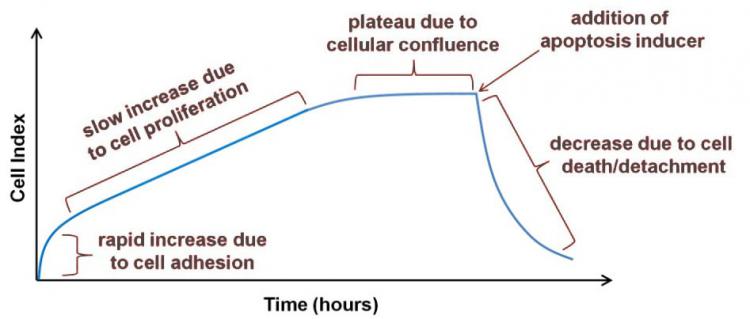 图4.
图4.用于建立和运行凋亡测定的通用实时阻抗曲线。 在文中解释了阻抗曲线的每个阶段及其产生的蜂窝行为。
超出上述通用示例,图5显示了使用ACEA的xCELLigence 实时无标记仪器中的E-Plate采集的实际实时阻抗数据。 图5A显示了将A549细胞加入到E-Plate板中的前两小时的阻抗曲线,其中孔预先用不同浓度的胶原IV包被。 虽然图5B显示了在将HeLa细胞暴露于GPCR激动剂多巴胺的前几分钟内发生的细胞指数的变化,图5C评估在20小时内NK细胞介导的癌细胞的细胞溶解。 图5D突出显示根据药物作用机制可能在细胞指数中发生的变化。
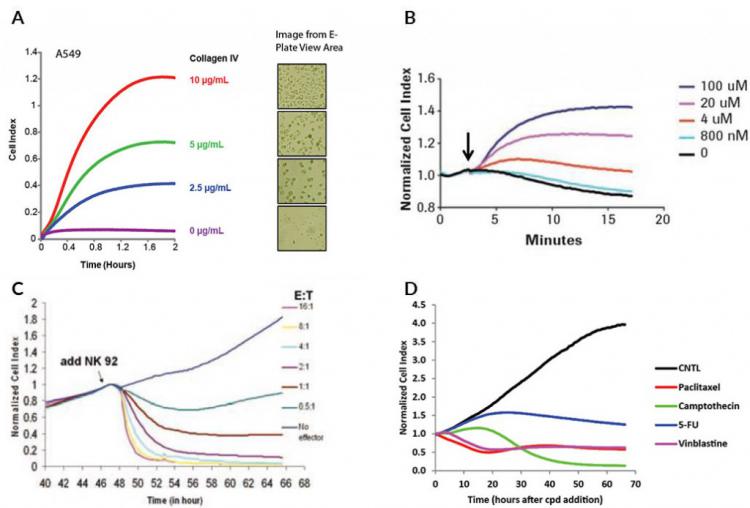
图5.使用E-Plate板和xCELLigence RTCA仪器获得的实时阻抗曲线示例。 (A)实时监测已经预先涂覆不同浓度胶原IV的E-Plate孔的A549细胞粘附。请注意阻抗值(细胞指数)与显微镜中可见的贴壁细胞数之间的相关性。 (B)暴露于不同浓度GPCR激动剂多巴胺的HeLa细胞的实时阻抗曲线。黑色箭头表示多巴胺加入的时间。 (C)用于NK细胞介导的MCF7乳腺癌细胞溶解的实时阻抗曲线。 (D)暴露于药物的A549细胞的实时阻抗曲线显示各种作用机制。
与细胞相关的阻抗
RTCA提供细胞数量,增殖率,细胞大小/形状和细胞 - 底物附着质量的定量读数。由于这些物理性质是数千种不同基因/蛋白质的产物,因此RTCA可以为细胞健康和行为提供非常广泛的视野。在xCELLigence仪器上已经成功地分析了从内皮屏障功能和趋化性到丝状伪足动力学和免疫细胞介导的细胞溶解的一切。尽管它们的广泛性,xCELLigence测定仍然能够询问非常具体的生化和细胞现象。适当使用对照和/或正交技术使得可以将阻抗迹线的特征与特定的细胞/分子现象相关联。
 细胞入侵和迁移实时测量 (RTCA)DP实时细胞分析仪
细胞入侵和迁移实时测量 (RTCA)DP实时细胞分析仪



 图5.使用E-Plate板和xCELLigence RTCA仪器获得的实时阻抗曲线示例。 (A)实时监测已经预先涂覆不同浓度胶原IV的E-Plate孔的A549细胞粘附。请注意阻抗值(细胞指数)与显微镜中可见的贴壁细胞数之间的相关性。 (B)暴露于不同浓度GPCR激动剂多巴胺的HeLa细胞的实时阻抗曲线。黑色箭头表示多巴胺加入的时间。 (C)用于NK细胞介导的MCF7乳腺癌细胞溶解的实时阻抗曲线。 (D)暴露于药物的A549细胞的实时阻抗曲线显示各种作用机制。
图5.使用E-Plate板和xCELLigence RTCA仪器获得的实时阻抗曲线示例。 (A)实时监测已经预先涂覆不同浓度胶原IV的E-Plate孔的A549细胞粘附。请注意阻抗值(细胞指数)与显微镜中可见的贴壁细胞数之间的相关性。 (B)暴露于不同浓度GPCR激动剂多巴胺的HeLa细胞的实时阻抗曲线。黑色箭头表示多巴胺加入的时间。 (C)用于NK细胞介导的MCF7乳腺癌细胞溶解的实时阻抗曲线。 (D)暴露于药物的A549细胞的实时阻抗曲线显示各种作用机制。